الببتيدات هي فئة من المركبات التي تشكلت عن طريق اتصال الأحماض الأمينية المتعددة من خلال روابط الببتيد. إنهم في كل مكان في الكائنات الحية. حتى الآن ، تم العثور على عشرات الآلاف من الببتيدات في الكائنات الحية. تلعب الببتيدات دورًا مهمًا في تنظيم الأنشطة الوظيفية لمختلف الأنظمة والأعضاء والأنسجة والخلايا وفي أنشطة الحياة ، وغالبًا ما تستخدم في التحليل الوظيفي ، وأبحاث الأجسام المضادة ، وتطوير الدواء وغيرها من المجالات. مع تطوير التكنولوجيا الحيوية وتكنولوجيا تخليق الببتيد ، تم تطوير وتطبيق المزيد من أدوية الببتيد في العيادة.
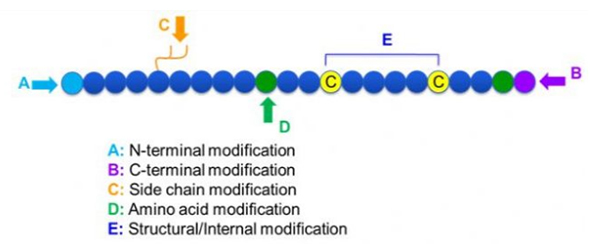
هناك مجموعة واسعة من تعديلات الببتيد ، والتي يمكن تقسيمها ببساطة إلى تعديل ما بعد وتعديل العملية (باستخدام تعديل الأحماض الأمينية المشتقة) ، وتعديل N-terminal ، وتعديل C-terminal ، وتعديل السلسلة الجانبية ، وتعديل الأحماض الأمينية ، وتعديل الهيكل العظمي ، وما إلى ذلك ، اعتمادًا على موقع التعديل (الشكل 1). كوسيلة مهمة لتغيير بنية السلسلة الرئيسية أو مجموعات السلسلة الجانبية من سلاسل الببتيد ، يمكن أن يغير تعديل الببتيد بشكل فعال الخصائص الفيزيائية والكيميائية لمركبات الببتيد ، وزيادة قابلية ذوبان المياه ، وإطالة وقت العمل في Vivo ، وتغيير توزيعها البيولوجي ، والقضاء على المناعة ، وتقليل الآثار الجانبية السامة ، وما إلى ذلك في هذه الورقة ، وعدة استراتيجيات تعديل الببتيد الرئيسية.
1. cyclization
الببتيدات الدورية لها العديد من التطبيقات في الطب الحيوي ، والعديد من الببتيدات الطبيعية مع النشاط البيولوجي هي الببتيدات الدورية. نظرًا لأن الببتيدات الدورية تميل إلى أن تكون أكثر صلابة من الببتيدات الخطية ، فإنها مقاومة للغاية للجهاز الهضمي ، ويمكنها البقاء في الجهاز الهضمي ، وتظهر تقاربًا أقوى للمستقبلات المستهدفة. يعد Cyclization الطريقة الأكثر مباشرة لتوليف الببتيدات الدورية ، وخاصة للببتيدات ذات الهيكل العظمي الهيكلي الكبير. وفقًا لوضع Cyclization ، يمكن تقسيمه إلى نوع سلسلة من جانب السلسلة الجانبي ، ونوع السلسلة الجانبية الطرفية ، والنوع الطرفي الطرفي (نوع إلى النهاية إلى النهاية).
(1) Sidechain to-sidechain
النوع الأكثر شيوعًا من السلسلة الجانبية إلى ركوب السلسلة الجانبية هو سد ثاني كبريتيد بين بقايا السيستين. يتم تقديم هذا الدراجات من خلال زوج من بقايا السيستين التي يتم إحباطها ثم تتأكسد لتشكيل روابط ثاني كبريتيد. يمكن تحقيق تخليق متعدد الحلقات عن طريق الإزالة الانتقائية لمجموعات حماية sulfhydryl. يمكن أن يتم cyclization إما في مذيب ما بعد التفتيش أو على راتنج ما قبل الإلغاء. قد يكون cyclization على الراتنجات أقل فعالية من ركوب المذيبات لأن الببتيدات على الراتنجات لا تشكل بسهولة مطابقة cycled. هناك نوع آخر من السلسلة الجانبية - السلسلة الجانبية للسلسلة الجانبية هو تكوين بنية أميد بين بقايا حمض الأسبارتيك أو بقايا حمض الجلوتاميك والحمض الأميني الأساسي ، مما يتطلب أن تكون مجموعة حماية السلسلة الجانبية قادرة على إزالتها بشكل انتقائي من البوليبتيد إما على الراتنج أو بعد الانفصال. النوع الثالث من سلسلة السلسلة الجانبية-السلسلة الجانبية هو تكوين إيثرات ثنائي الفينيل بواسطة التيروزين أو p-hydroxyphenylglycine. يوجد هذا النوع من الدراجات في المنتجات الطبيعية فقط في المنتجات الميكروبية ، وغالبا ما يكون لمنتجات الدوران قيمة طبية محتملة. يتطلب إعداد هذه المركبات ظروف تفاعل فريدة ، لذلك لا يتم استخدامها في كثير من الأحيان في تخليق الببتيدات التقليدية.

(2) طرفي إلى sidechain
عادةً ما تتضمن Cyclization سلسلة من جانب الطرفي الطرف C مع المجموعة الأمينية من سلسلة ليسين أو أونيثين الجانبية ، أو الطرف N مع حامض الأسبارتيك أو السلسلة الجانبية لأحماض الجلوتاميك. يتم تصنيع ركوب الببتيد الآخر عن طريق تكوين روابط الأثير بين الطرف C والسلاسل الجانبية للسيرين أو ثريونين.
(3) نوع الطرفية أو من الرأس إلى ذيل
يمكن إما ركوب ببتيدات السلسلة في مذيب أو مثبت على راتنج من خلال الدراجات السلسلة الجانبية. يجب استخدام تركيزات منخفضة من الببتيدات في مركزية المذيبات لتجنب قلة الببتيدات. يعتمد محصول polypeptide الاصطناعية من وجها لوجه على تسلسل ببتيد السلسلة. لذلك ، قبل إعداد الببتيدات الدورية على نطاق واسع ، ينبغي أولاً إنشاء مكتبة من الببتيدات المحتملة للسلاسل ، تليها الدراجة لإيجاد التسلسل مع أفضل النتائج.
2. n-methylation
يحدث ميثيل n في الأصل في الببتيدات الطبيعية ويتم إدخاله في تخليق الببتيد لمنع تكوين روابط الهيدروجين ، مما يجعل الببتيدات أكثر مقاومة للتحلل الحيوي والتخليص. تخليق الببتيدات باستخدام مشتقات الأحماض الأمينية N-methylated هي الطريقة الأكثر أهمية. بالإضافة إلى ذلك ، يمكن أيضًا استخدام تفاعل Mitsunobu من N- (2-nitrobenzene sulloride-chloride)-الوسيطة ذات الرئاسة الببتيد مع الميثانول. تم استخدام هذه الطريقة لإعداد مكتبات الببتيد الدورية التي تحتوي على أحماض أمينية n ميثيل.
3. الفسفرة
الفسفرة هي واحدة من أكثر التعديلات شيوعًا بعد التحول في الطبيعة. في الخلايا البشرية ، يتم فسفرة أكثر من 30 ٪ من البروتينات. يلعب الفسفرة ، وخاصة الفسفرة القابلة للانعكاس ، دورًا مهمًا في التحكم في العديد من العمليات الخلوية ، مثل نقل الإشارة ، والتعبير الجيني ، ودورة الخلية وتنظيم الهيكل الخلوي ، وموت الخلايا المبرمج.
يمكن ملاحظة الفسفرة في مجموعة متنوعة من بقايا الأحماض الأمينية ، ولكن أهداف الفسفرة الأكثر شيوعًا هي بقايا السيرين والثريونين والتيروزين. يمكن إما إما فوسفوتريوسين ، فوسفوثريونين ، ومشتقات الفوسفوسرين إما إلى الببتيدات أثناء التوليف أو تشكل بعد تخليق الببتيد. يمكن تحقيق الفسفرة الانتقائية باستخدام بقايا سيرين ، ثريونين ، وتيروزين التي تزيل مجموعات الحماية بشكل انتقائي. يمكن لبعض الكواشف الفسفرة أيضًا إدخال مجموعات حمض الفوسفوريك في الببتيد عن طريق تعديل ما بعد. في السنوات الأخيرة ، تم تحقيق فسفرة ليسين الخاصة بالموقع باستخدام تفاعل Staudinger-phosphite انتقائي كيميائيًا (الشكل 3).

4. myristoylation و palmitoylation
يسمح acylation من الطرف N مع الأحماض الدهنية للببتيدات أو البروتينات بالربط بأغشية الخلايا. يمكّن التسلسل Myridamoylated على الطرف N كينازات بروتين عائلة SRC وبروتينات GAQ العكسية لربط أغشية الخلايا. تم ربط الحمض المريسي إلى الطرف N من الببتيد الراتنج باستخدام تفاعلات الاقتران القياسية ، ويمكن فصل الببتيد الناتج في الظروف القياسية وتنقيته بواسطة RP-HPLC.
5. الغليكوزيل
غليكوببتيدات مثل فانكومايسين وتيكولانين هي مضادات حيوية مهمة لعلاج التهابات البكتيرية المقاومة للعقاقير ، وغالبا ما تستخدم جليكوببتيدات أخرى لتحفيز الجهاز المناعي. بالإضافة إلى ذلك ، نظرًا لأن العديد من المستضدات الميكروبية عبارة عن غليكوزيل ، فمن الأهمية بمكان دراسة جليكوببتيدات لتحسين التأثير العلاجي للعدوى. من ناحية أخرى ، وجد أن البروتينات الموجودة على غشاء الخلايا للخلايا السرطانية تظهر غليكوزيل غير طبيعية ، مما يجعل جليكوببتيدات تلعب دورًا مهمًا في أبحاث السرطان والمناعة للورم. يتم تحضير glycopeptides بواسطة طريقة FMOC/T-BU. غالبًا ما يتم إدخال بقايا الجليكوزيل ، مثل الثريونين والسيرين ، في البوليبتيدات بواسطة FMOCs التي تنشط استرات الخماسي الفلوي لحماية الأحماض الأمينية الجليكوزيلة.
6. isoprene
يحدث isopentadienylation على بقايا السيستين في السلسلة الجانبية بالقرب من الطرف C. يمكن للبروتين الإيزوبرن تحسين تقارب غشاء الخلية وتشكيل تفاعل البروتين البروتين. تشمل البروتينات المتساوية في الفوسفاتيز التيروزين ، و GTase الصغيرة ، وجزيئات كوشبرون ، والصلات النووية ، وبروتينات الربط المركزي. يمكن تحضير البوليبتيدات الإيزوبرين باستخدام الإيزوبرين على الراتنجات أو عن طريق إدخال مشتقات السيستين.
7. تعديل البولي إيثيلين جليكول (PEG)
يمكن استخدام تعديل PEG لتحسين الاستقرار المائي للبروتين والتوريد الحيوي وذوبان الببتيد. يمكن أن يؤدي إدخال سلاسل PEG إلى الببتيدات إلى تحسين خصائصها الدوائية وكذلك يمنع التحلل المائي للببتيدات بواسطة الإنزيمات المحللة البروتينية. تمر الببتيدات PEG عبر المقطع العرضي الشعري الكبيبي بسهولة أكبر من الببتيدات العادية ، مما يقلل بشكل كبير من خلوص الكلى. بسبب النصف النشط الممتد للببتيدات PEG في الجسم الحي ، يمكن الحفاظ على مستوى العلاج الطبيعي بجرعات أقل وأدوية الببتيد الأقل تكرارًا. ومع ذلك ، فإن تعديل PEG له أيضًا آثار سلبية. تمنع كميات كبيرة من PEG الإنزيم من تحلل الببتيد وأيضًا تقليل ارتباط الببتيد بالمستقبل المستهدف. ولكن عادة ما يتم تعويض تقارب الببتيدات المنخفضة للببتيدات الدوائية الطويلة ، ومن خلال وجودها في الجسم لفترة أطول ، يكون للببتيدات الوتد احتمال امتصاص أكبر في الأنسجة المستهدفة. لذلك ، يجب تحسين مواصفات بوليمر PEG لتحقيق النتائج المثلى. من ناحية أخرى ، تتراكم الببتيدات PEG في الكبد بسبب انخفاض خلوص الكلى ، مما يؤدي إلى متلازمة الجزيئات الكبيرة. لذلك ، يجب تصميم تعديلات PEG بعناية أكبر عند استخدام الببتيدات لاختبار المخدرات.

يمكن تلخيص مجموعات التعديل الشائعة لموضوعات PEG تقريبًا على النحو التالي: الأمين (أمين) -NH2 ، الأمينوميثيل -CH2 -NH2 ، Hydroxy -OH ، كربوكسي -كوه ، سلفهيدريل (-Thiol) -sh ، maleimide -mal ، succinimide carbarate -sc ، acetate -scinimide ، N-hydroxysuccinimide -nhs ، acrylate-ch2ch2cooh ، aldehyde -cho (مثل propional-ald ، butyrald) ، قاعدة أكريليك (-Acrylate-Acrl) ، alkyne-alkyne-alkynene ، alkyne-alkynehe ، alkynenee. P -toluenesulfonate -its ، succinimide succinent -ss ، إلخ. يمكن أن تقترن مشتقات PEG مع الأحماض الكربوكسيلية مع الأمينات الطرفية أو السلاسل الجانبية ليسين. يمكن اقتران PEG المنشط الأميني مع حمض الأسبارتيك أو سلاسل الجانبية لأحماض الجلوتاميك. يمكن ربط PEG المنشط إلى Mercaptan من سلاسل الجانبية السيستين المحددة بالكامل [11]. يتم تصنيف معدلات PEG بشكل شائع على النحو التالي (ملاحظة: MPEG هو methoxy-PEG ، CH3O- (CH2CH2O) N-ch2CH2-OH):
(1) معدل ربط سلسلة مستقيمة
MPEG-SC ، MPEG-SCM ، MPEG-SPA ، MPEG-LOTS ، MPEG-SH ، MPEG-Ald ، MPEG-BUTYRALD ، MPEG-SS
(2) معدّة ربط ثنائي الوظيفة
HCOO-PEG-COOH ، NH2-PEG-NH2 ، OH-PEG-COOH ، OH-PEG-NH2 ، HCL · NH2-PEG-COOH ، MAL-PEG-NHS
(3) تعديل ربط المتفرعة
(MPEG) 2-NHS ، (MPEG) 2-ALD ، (MPEG) 2-NH2 ، (MPEG) 2-MAL
8. biotinization
يمكن أن يكون البيوتين مرتبطًا بقوة بالأفيدين أو الستربتافيدين ، وتكون قوة الربط قريبة من الرابطة التساهمية. تُستخدم الببتيدات المسمى البيوتين بشكل شائع في المقايسة المناعية ، والكيمياء النسيجية ، وقياس التدفق الخلوي القائم على مضان. يمكن أيضًا استخدام الأجسام المضادة المضادة للمضادات الحيوية لربط الببتيدات البيوتينية. غالبًا ما يتم ربط ملصقات البيوتين بسلسلة ليسين الجانبية أو محطة N. غالبًا ما يستخدم حمض الأمينوكابويك كرابطة بين الببتيدات والبيوتين. الرابطة مرنة في الارتباط بالركيزة وترتبط بشكل أفضل في وجود عوائق متعددة.
9. وضع العلامات الفلورية
يمكن استخدام العلامات الفلورية لتتبع الببتيدات في الخلايا الحية ودراسة الإنزيمات وآليات العمل. التربتوفان (TRP) فلوريسنت ، بحيث يمكن استخدامه لوضع العلامات الجوهرية. يعتمد طيف انبعاث التربتوفان على البيئة المحيطية ويتقلص مع انخفاض قطبية المذيبات ، وهي خاصية مفيدة للكشف عن بنية الببتيد وربط المستقبلات. يمكن إخماد مضان التربتوفان بواسطة حمض الأسبارتيك البروتوني وحمض الجلوتاميك ، مما قد يحد من استخدامه. تكون مجموعة كلوريد Dansyl (Dansyl) فلورسنت للغاية عندما تكون مرتبطة بمجموعة أمينية وغالبًا ما يتم استخدامها كعلامة فلورسنت للأحماض الأمينية أو البروتينات.
إن تحويل طاقة الرنين الفلوري (FRET) مفيد لدراسات الإنزيم. عندما يتم تطبيق FRET ، يحتوي الببتيد على الركيزة عادةً على مجموعة تسمية مضان ومجموعة من التفتيش. يتم إخماد مجموعات الفلورسنت المسمى بواسطة Quencher من خلال نقل الطاقة غير الفوتون. عندما يتم فصل الببتيد عن الإنزيم المعني ، تنبعث مجموعة العلامات مضان.
10. قفص polypeptides
تحتوي الببتيدات القفص على مجموعات وقائية قابلة للإزالة بصريًا تحمي الببتيد من الارتباط بالمستقبل. عند تعرضه للإشعاع بالأشعة فوق البنفسجية ، يتم تنشيط الببتيد ، مع استعادة تقاربه للمستقبل. نظرًا لأنه يمكن التحكم في هذا التنشيط البصري وفقًا للوقت أو السعة أو الموقع ، يمكن استخدام الببتيدات القفص لدراسة التفاعلات التي تحدث في الخلايا. مجموعات الحماية الأكثر استخدامًا للببتيدات القفص هي مجموعات 2-nitrobenzyl ومشتقاتها ، والتي يمكن إدخالها في تخليق الببتيد عبر مشتقات الأحماض الأمينية الواقية. مشتقات الأحماض الأمينية التي تم تطويرها هي ليسين ، السيستين ، سيرين ، وتيروزين. ومع ذلك ، لا يتم استخدام مشتقات الأسبارتات والغلوتامات بشكل شائع بسبب قابليتها للدراجة أثناء توليف الببتيد والانفصال.
11. الببتيد البولي أنتينيك (خريطة)
عادة ما تكون الببتيدات القصيرة غير محصنة ويجب أن تقترن ببروتينات الناقل لإنتاج أجسام مضادة. يتكون الببتيد polyantigenic (MAP) من ببتيدات متطابقة متعددة متصلة بنواة ليسين ، والتي يمكن أن تعبر على وجه التحديد من المناعيات عالية الفاعلية ويمكن استخدامها لإعداد مقاطع بروتين الببتيد. يمكن تصنيع polypeptides MAP بواسطة تخليق الطور الصلب على راتنج الخريطة. ومع ذلك ، يؤدي الاقتران غير المكتمل إلى سلاسل الببتيد المفقودة أو المقطوعة على بعض الفروع ، وبالتالي لا تظهر خصائص بولي ببتيد الخريطة الأصلية. كبديل ، يمكن تحضير الببتيدات وتنقيتها بشكل منفصل ثم اقترنها إلى الخريطة. يتم تعريف تسلسل الببتيد المرتبط بنواة الببتيد بشكل جيد ويتميز بسهولة بالحيوانات الطيف الكتلي.
خاتمة
تعديل الببتيد هو وسيلة مهمة لتصميم الببتيدات. لا يمكن للببتيدات المعدلة كيميائيًا الحفاظ على نشاط بيولوجي عالي فحسب ، بل يمكن أيضًا تجنب عيوب المناعة والسمية بشكل فعال. في الوقت نفسه ، يمكن أن يمنح التعديل الكيميائي الببتيدات مع بعض الخصائص الممتازة الجديدة. في السنوات الأخيرة ، تم تطوير طريقة تنشيط C-H لبعد التعديل للببتيدات بسرعة ، وقد تم تحقيق العديد من النتائج المهمة.
وقت النشر: 2025-07-03
